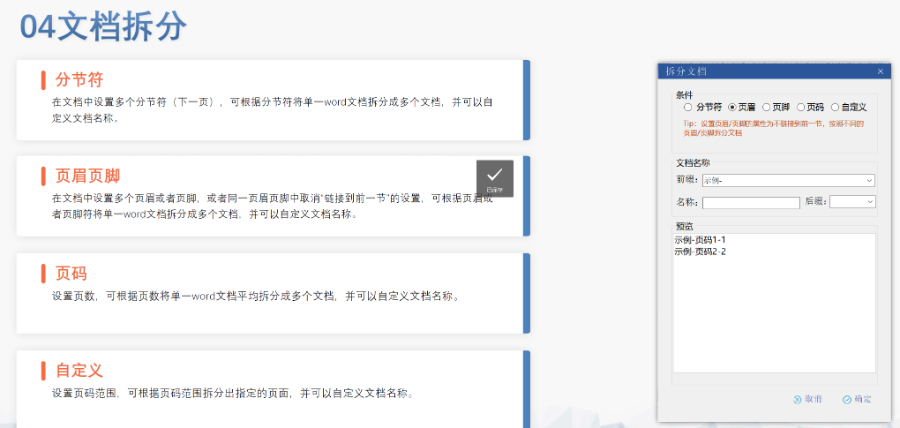
商機詳情 -
國際注冊eCTD性價比
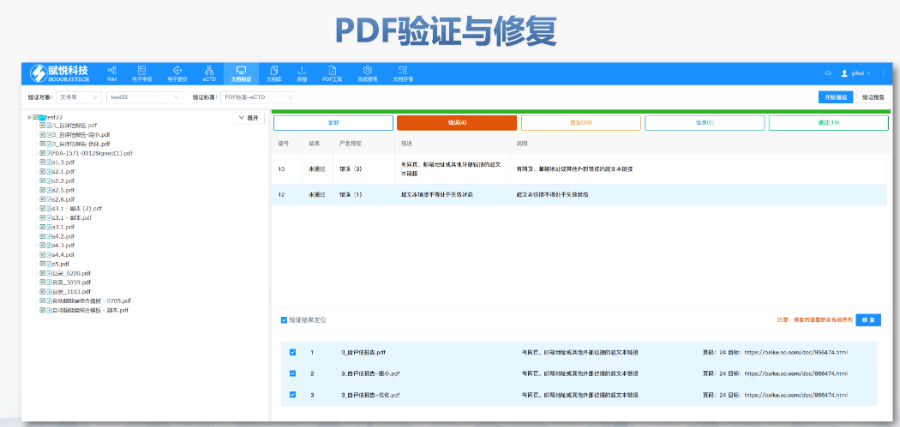
PDF工具箱 ?批量處理與格式修復 支持PDF合并、拆分、提取頁面、旋轉頁面等操作,可批量修復字體未嵌入、超鏈接錯誤等問題,確保文件符合藥品注冊法規要求。 ?智能書簽與超鏈接管理 提供書簽導入/導出、超鏈接自動生成(支持關鍵字搜索定位鏈接)、題注超鏈接拖拽式編輯等功能,簡化復雜文檔的導航設計。 ?文檔轉換與OCR識別 支持Word轉PDF(自動生成書簽、嵌入字體),以及PDF與Word、Excel等格式互轉,集成OCR功能用于掃描件文字識別。 ?合規性驗證 自動驗證PDF的頁面布局、頁碼連續性、空白頁、目錄層級等屬性,并定位具體錯誤位置,減少人工檢查成本。 ?安全與協作功能 支持文檔加密、數字簽名、云端同步及多設備共享,滿足企業級文件安全管理需求。瑞士DMF注冊申報相關技術支持。國際注冊eCTD性價比
中國將進一步與國際接軌,推進eCTD等標準應用,提高藥品注冊效率和質量。AI技術可能在藥品注冊領域廣泛應用,如輔助審評人員工作。未來藥品注冊資料將更注重結構化數據,有助于監管機構高效獲取和利用數據。 eCTD等數字化工具將推動藥品監管向智慧監管和全生命周期監管發展,提高監管效率和質量。區塊鏈技術具有應用前景,可構建全球統一的藥品申報數據平臺。數據化時代,藥品注冊領域將更注重數據收集、分析和利用,為監管機構和企業提供決策支持。 總而言之,展望未來,隨著eCTD在藥品注冊領域的廣泛應用和不斷發展,中國將逐步建立起與國際接軌的藥品注冊體系。這將有助于提高中國藥品注冊的效率和質量,推動中國藥品走向世界舞臺。同時,企業也需要密切關注技術發展動態和監管政策變化,及時調整自身戰略和規劃,以適應未來的市場競爭和監管要求。高新區國際注冊eCTD推薦美國eCTD注冊外包相關技術支持。
電子遞交的合規性與風險管理 歐盟要求申請人確保電子資料與紙質版本完全一致,若未在規定時間提交紙質文件可能導致注冊終止。驗證過程中,“錯誤”級別問題(如文件命名不規范、XML邏輯錯誤)必須修正,而“警告”和“提示信息”則建議優化以提升審評體驗。EDQM和EMA均提供驗證工具,申請人需在遞交前完成內部預驗證。 官方費用結構與支付流程 歐盟eCTD遞交費用因審評程序類型而異:集中程序費用較高,涵蓋科學評估和合規審查成本;國家程序費用由各成員國自行設定。CEP申請需向EDQM支付評審費,具體金額根據原料藥類型和變更復雜度分級。繳費需通過官方指定渠道完成,并附上付款憑證作為模塊1的組成部分。 多語言支持與翻譯要求 盡管歐盟允許使用英語提交,但部分成員國要求模塊一的行政文件翻譯為本地語言。臨床試驗數據庫(如SDTM和ADaM)需以英語呈現,同時提供雙語標簽以支持多國審閱。專業翻譯服務在確保技術術語準確性方面至關重要,尤其針對復雜藥學和非臨床數據。
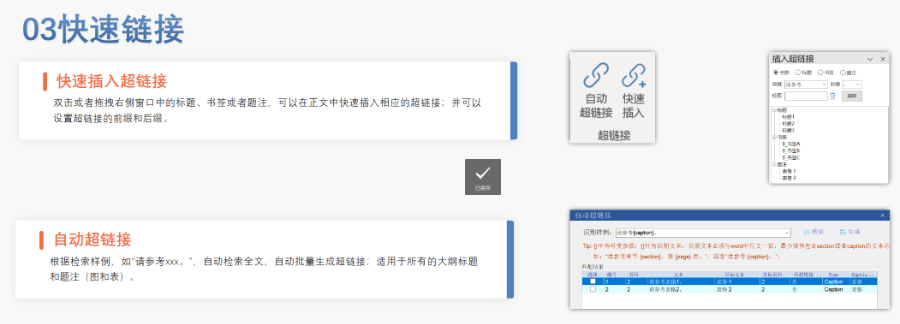
歐洲藥品管理局:集中審評程序由歐洲藥品管理局(European Medicines Agency, EMA)負責協調。 人用藥品委員會:人用藥品委員會(Committee for Medicinal Products for Human Use, CHMP)負責提供科學意見。 歐盟委員會:CHMP的意見隨后被提交給歐盟委員會(European Commission, EC),由歐盟委員會做出是否授權的終決定。這個決定在整個歐盟都是具有法律約束力的。 審批過程: 申請人向EMA提交申請,包括eCTD(電子通用技術文檔)格式的藥品注冊文檔。 EMA的CHMP分配一個科學評估團隊(Rapporteur和Co-Rapporteur),負責初步評估。 CHMP基于評估團隊的報告提供科學意見。 歐盟委員會根據CHMP的意見做出終決定,批準或拒絕藥品上市。 授權范圍 如果藥品獲得批準,將獲得在整個歐盟、冰島、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA)。美國注冊鄧白氏號申請相關技術支持。
美國eCTD驗證采用三級分類:“錯誤”(必須修正)、“警告”(建議修正)、“提示信息”(參考)。例如,PDF文件版本不符或加密保護屬于“錯誤”,而書簽路徑非相對性則可能列為“警告”。驗證失敗將直接導致退審,企業需通過LORENZ Validator等工具預檢,確保提交前合規。 ?技術驗證點 驗證涵蓋XML結構合規性、文件命名規則、生命周期管理(如序列號連續性)及PDF屬性(如字體嵌入、可搜索性)。臨床試驗數據需額外滿足CDISC標準,包括SDTM和ADaM數據集的結構驗證eCTD注冊咨詢相關技術支持。合肥CDE eCTD報價
澳大利亞NDA注冊申報相關技術支持。國際注冊eCTD性價比
eCTD提交流程與ESG系統:FDA要求通過電子提交網關(ESG)傳輸eCTD文件,單個文件大小限制為10GB,超限需拆分或通過物理介質(如光盤)遞交。提交前需預分配申請號(如NDA編號),并通過ESG測試賬戶驗證技術合規性。序列號命名規則為4位數字(如0001),申請需從“原申請”序列開始,補充資料按遞增順序編號。企業可自愿提交預審樣本(Pre-Submission),FDA將反饋文檔結構、元數據等合規性問題。驗證標準與常見錯誤類型:FDA驗證標準分為高(High)、中(Medium)、低(Low)三級,高風險錯誤(如無效XML或缺失關鍵表格)必須修復,否則直接拒收。常見問題包括:重復序列號(錯誤1034)、文件路徑超長(警告2015)、PDF加密或非標字體(錯誤4001)。2023年統計顯示,30%的提交因模塊1格式錯誤被退回,凸顯行政信息合規的重要性。驗證工具如LORENZ eValidator被FDA官方采用,可自動檢測200+項技術指標。國際注冊eCTD性價比