商機詳情 -
差異蛋白表達量
體外蛋白表達系統的明顯缺陷在于 缺乏真核細胞器結構,導致關鍵翻譯后修飾難以實現:糖基化不完整性: 裂解物中缺乏高爾基體轉運機制,只能生成高甘露糖型等簡單糖鏈,無法合成復雜雙觸角N-糖;磷酸化/乙酰化失衡: 激酶/磷酸酶網絡不完整,使信號通路蛋白的修飾狀態與生理條件差異明顯;二硫鍵錯配風險: 氧化還原環境調控不足導致多二硫鍵蛋白錯誤折疊率升高。這些局限使體外蛋白表達在 zhi liao性抗體等需精確修飾的蛋白生產中應用受限。大腸桿菌裂解物添加含T7啟動子的線性DNA后,利用其??高密度核糖體??快速啟動蛋白表達。差異蛋白表達量

體外蛋白表達技術的重點在于利用細胞裂解物中的生物合成機器(核糖體、tRNA、翻譯因子)在試管中直接合成蛋白質。以大腸桿菌系統為例:首先制備含T7啟動子的線性DNA模板,將其與商業化裂解物(如RocheRTS100)、能量混合物(ATP/GTP)及20種氨基酸混合,在37℃振蕩反應2-4小時即可完成蛋白表達。整個過程無需細胞培養與基因轉染,速度比傳統方法快10倍以上。例如,COVID19刺突蛋白RBD結構域的體外表達只需6小時,而HEK293細胞系統需5天。該技術的關鍵優勢是開放體系的可編程性——可直接添加非天然氨基酸(如Azidohomoalanine)合成定制化蛋白,為藥物偶聯物開發提供高效平臺。293t蛋白蛋白表達protocol通過體外蛋白表達,只需在裂解物中添加對應mRNA,就能在裂解物中安全實現dusu合成及機制研究。
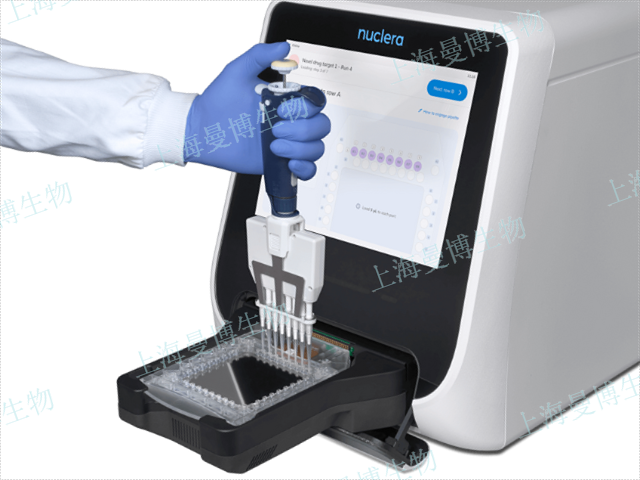
無細胞蛋白表達技術(CFPS)的he xin組分包括細胞裂解物(如大腸桿菌、兔網織紅細胞或小麥胚芽提取物),其中含有核糖體、tRNA、氨酰-tRNA合成酶及轉錄/翻譯因子(如啟動/延伸/終止因子)。此外,系統需補充能量再生系統(如ATP、磷酸肌酸與肌酸激酶)以維持反應持續進行,以及底物(氨基酸、核苷酸)和輔因子(Mg2?、K?等)以支持蛋白質合成。例如,大腸桿菌S30提取物常通過敲除核酸酶和蛋白酶來提升蛋白穩定性。英國nuclera高通量微流控蛋白表達篩選系統可支持助力無細胞蛋白表達技術,如想更多關于該產品的信息,歡迎咨詢官方代理商上海曼博生物!
無細胞蛋白表達技術(CFPS)雖然具有快速、靈活等優勢,但仍存在一些關鍵缺點。首先,成本較高,商業化裂解物、能量試劑和酶的價格昂貴,小規模實驗單次反應成本可達數百元,大規模生產的經濟性尚未完全解決。其次,蛋白產量較低,反應通常在幾小時內終止,產量(0.1-1 mg/mL)遠低于細胞表達系統(如大腸桿菌可達10 mg/mL以上)。此外,復雜蛋白表達受限,原核裂解物缺乏真核翻譯后修飾能力(如糖基化),而真核裂解物成本更高;部分蛋白可能因折疊不完全而喪失活性。技術操作上,反應條件(pH、離子強度等)需精細調控,且線性DNA模板易降解,增加了實驗難度。CFPS目前更適合小規模應用,在超長蛋白(>100 kDa)表達和工業化連續生產方面仍面臨挑戰。未來需通過開發低成本試劑、優化能量再生系統和自動化工藝來突破這些瓶頸。體外蛋白表達作為??現代分子生物學的重要工具之一??。

國內生物醫藥行業對CFPS的價值認知不足,傳統企業更依賴成熟的細胞表達系統(如CHO、大腸桿菌)。許多藥企認為無細胞蛋白表達技術只適用于“科研級小試”,對其在藥物開發(如ADC定點偶聯)、mRNA疫苗抗原快速制備等工業化潛力持觀望態度。同時,無細胞蛋白表達技術在復雜蛋白表達(如糖基化抗體)上的局限性也削弱了市場信心。相比之下,歐美已形成“CRO+藥企”的協同生態(如Moderna與CFPS服務商合作),而國內缺乏此類模范案例,導致技術推廣缺乏驅動力。大腸桿菌裂解物的??高翻譯效率??可支持??100μg/mL級??蛋白產量,限制造就完整功能的真**白表達。定制蛋白表達注意事項
從模板添加到獲得功能性體外表達蛋白只需6小時??,而HEK293系統需兩周。差異蛋白表達量
前沿高校和研究所是無細胞蛋白表達技術創新的源頭。哈佛大學George Church實驗室開發的"全基因組裂解物"技術,明顯提升了復雜途徑的體外重構能力;東京大學則通過微流控-無細胞蛋白表達技術聯用系統,推動單細胞蛋白組學研究。值得注意的是,合成生物學公司(如Ginkgo Bioworks、Zymergen)正將無細胞蛋白表達技術納入其自動化生物鑄造平臺,用于高通量酶進化。而傳統發酵技術公司(如DSM)也開始布局無細胞蛋白表達技術,探索其在可持續蛋白(如無細胞合成乳清蛋白)中的應用,預示著技術融合的跨界競爭趨勢。差異蛋白表達量