商機詳情 -
珠海正規外泌體提取試劑推薦廠家
外泌體是一種存在于細胞外的多囊泡體,可通過細胞內吞泡膜向內凹陷形成多泡內涵體,內涵體與細胞膜融合后釋放其中的小囊泡。外泌體的直徑在40-110nm之間,其中包含RNA、蛋白質、microRNA、DN段等多種物質,存在于血液、唾液、尿液、腦脊液和母乳等多種體液中。外泌體從發現至今已有30多年的歷史,雖然較初被認為可能是細胞的“垃圾”,所以才被排出來,但是近年來研究表明外泌體具有功能活性并可進行細胞間信息傳遞。如今,研究已經發現外泌體在抗原提呈細胞中呈遞抗原程中、一些病癥細胞發生的發展、神經細胞信號轉導過程中都發揮著重要作用。外泌體提取:差速離心。差速離心仍然是較常見的外泌體分離技術之一。珠海正規外泌體提取試劑推薦廠家

外泌體提取:尺寸排阻色譜。尺寸排阻色譜(Size-exclusionchromatography,SEC)是基于大小而非分子量實現分離大分子。該技術應用填充多孔聚合物微球的柱子,分子根據其直徑通過微球,半徑小的分子需要更長的時間才能通過色譜柱的孔隙遷移,而大分子則從色譜柱中更早地洗脫。尺寸排阻色譜可以精確分離大小分子。此外,可以將不同的洗脫溶液應用于該方法。與離心方法相比,色譜分離已被證明具有更多優勢,因為通過色譜分離的外泌體不受剪切力的影響,這可能會改變囊泡的結構。目前,SEC是一種普遍接受的分離血液和尿液中外泌體的技術。不過,該方法耗時較長,不適合大量樣本處理重慶正規外泌體提取試劑推薦廠家由于外泌體的特殊結構和功能,使得它具有潛在的應用價值。
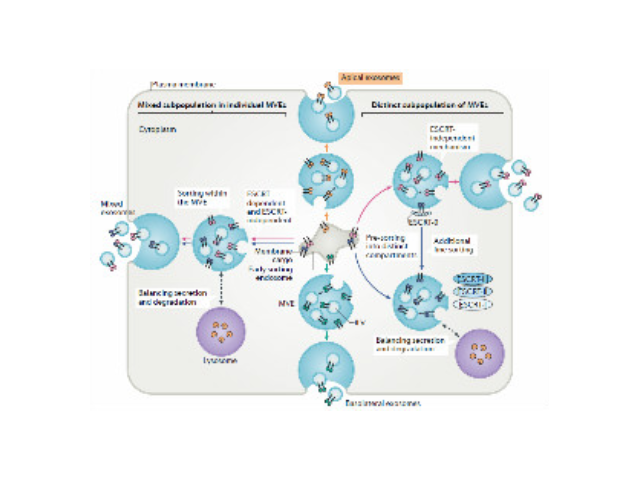
人體內多種細胞及體液均可分泌外泌體,包括內皮細胞、免疫細胞、血小板、平滑肌細胞等。當其由宿主細胞被分泌到受體細胞中時,外泌體可通過其攜帶的蛋白質、核酸、脂類等來調節受體細胞的生物學活性。外泌體介導的細胞間通訊主要通過以下三種方式:一是外泌體膜蛋白可以與靶細胞膜蛋白結合,進而啟動靶細胞細胞內的信號通路。二是在細胞外基質中,外泌體膜蛋白可以被蛋白酶剪切,剪切的碎片可以作為配體與細胞膜上的受體結合,從而啟動細胞內的信號通路。有報道稱一些外泌體膜上蛋白在其來源細胞膜上未能檢測出。三是外泌體膜可以與靶細胞膜直接融合,非選擇性的釋放其所含的蛋白質、mRNA以及microRNA。
外泌體的提取的方式:1、免疫磁珠法,這種方法可以保證外泌體形態的完整,特異性高、操作簡單、不需要昂貴的儀器設備,但是非中性pH和非生理性鹽濃度會影響外泌體生物活性,不便進行下一步的實驗。2、PS親和法,該方法將PS(磷脂酰絲氨酸)與磁珠結合,利用親和原理捕獲外泌體囊泡外的PS。該方法與免疫磁珠法相似,獲得的外泌體形態完整,純度較高。由于不使用變性劑,不影響外泌體的生物活性,外泌體可用于細胞共培養和體內注射。2016.9《ScientificReports》雜志發表了該方法較新數據,表明PS法可提取相當高純度的外泌體。六是色譜法,這種方法分離到的外泌體在電鏡下大小均一,但是需要特殊的設備,應用不普遍。外泌體提純試劑盒的特色與優勢:樣本輸入量多樣。
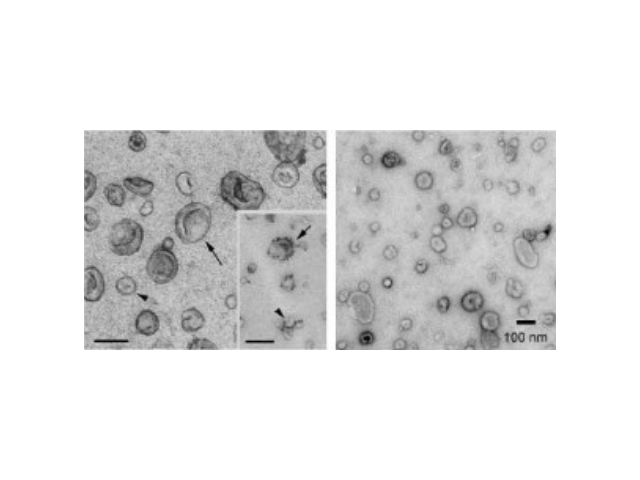
外泌體(Exosome)是細胞主動分泌的囊泡樣小體,大小均一,直徑30-200nm,密度1.10-1.18g/ml,來源普遍,幾乎所有細胞都可分泌,在血液,尿液,唾液,腦脊液,腹水,乳汁等體液中普遍分布。外泌體較早在1986年發現于培養的綿羊紅細胞上清液中。1996年,研究者發現外泌體作為抗原呈遞因子參與T細胞依賴的抗一些病癥反應,開啟了外泌體蛋白研究的新天地。2013年諾貝爾生物/醫學獎解答了細胞如何組織其內部較重要的運輸系統之一——囊泡傳輸系統的奧秘。超離法因操作簡單,獲得的囊泡數量較多而廣受?歡迎,但過程比較費時,且回收率不穩定,純度也受到質疑。逐漸取代超速離心法并推廣開來。有些試劑盒操作簡便,不用超速離心。蕪湖正規外泌體提取試劑銷售廠家
在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。珠海正規外泌體提取試劑推薦廠家
外泌體研究思路。外泌體研究通常與高通量測序的聯系緊密,研究思路可以分為三大類:表達譜、分子標志物和分子機制方向,其中表達譜思路的特點就是短平快、通常以測序數據為主要內容,短平快發表3-5分文章。而分子標志物的特點是在表達譜基礎之上加入大量樣本驗證,建立ROC、KM曲線,分析分子與臨床疾病的相關性為主,通常文章影響因子在3-10分之間。分子機制研究,顧名思義要做到細胞功能、機制研究深度,因此工作量通常較大,影響因子通常能夠上10+。唐山正規外泌體提取試劑產品介紹在體內參與細胞通訊、細胞遷移、促血管新生和抗一些病癥免疫等生理過程,與多種疾病的發生和進程密切相關珠海正規外泌體提取試劑推薦廠家