商機詳情 -
南昌正規外泌體提取試劑推薦廠家
外泌體的提取、分離方法:梯度密度離心法。研究發現,外泌體的密度在1.1~1.19kg·L-1之間,因此,可以采用密度梯度離心法來分離外泌體。該方法是將超速離心結合蔗糖密度梯度或蔗糖墊結合,原理是先除去非囊泡物質,再通過梯度密度濃縮提取外泌體,該方法可以得到相對較為純凈的外泌體。傳統的梯度密度方法通常需要離心16h,但是2012年,研究者[15]使用了62~90h才分離出某些確切囊泡,因此,該方法可能不足以沉淀所有的外泌體。如果離心時間不充足,污染物質可能和外泌體保持在相同的密度層,特別是這個密度范圍又比較寬。有關他們分泌和攝取及其組成、“運載物”和相應功能的精確分子機制剛剛開始研究。南昌正規外泌體提取試劑推薦廠家

外泌體的提取方法學規范、統一定量及鑒定等。關于外泌體的提取有超速離心、試劑盒、超濾法、蔗糖密度梯度離心等,然而各種方法均有其利弊。超速離心法是目前外泌體相關文章中的主流方法,由于離心步驟繁瑣,費事費力,而且步驟多導致實驗中容易污染,且損耗量大,使得較終回收的外泌體不穩定。而且對于抽提細胞上清來說,更是極為不請便,試想用提取300ml的上清需要6個50ml離心管,無論是過濾還是后續的每一步的離心去沉淀,都具有操作極其不便的缺點,總之非常麻煩。而超濾法存在外泌體會堵塞膜孔,造成濃縮效率低,濃縮管重復利用差,甚至堵塞在膜孔的外泌體還可能會粘連成團,造成損失及較后的數據有誤差,對于后續實驗也有影響。太原正規外泌體提取試劑報價外泌體提取:基于聚合物的沉淀技術。

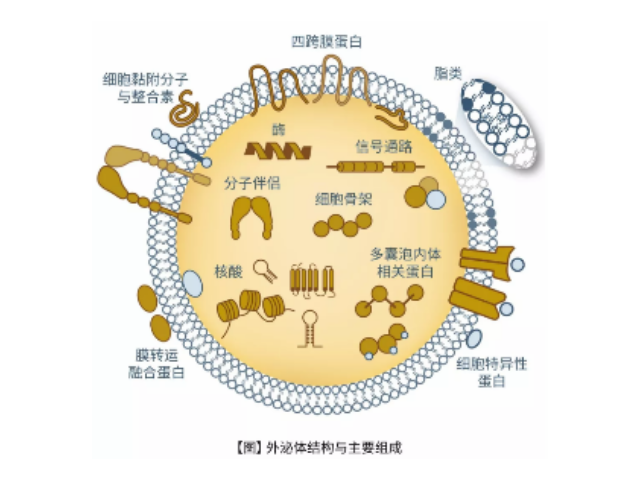
外泌體(exosome),特指直徑在40-100nm的盤狀囊泡。其主要來源于細胞內內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中。現已證實可以分泌外泌體的細胞有:肥大細胞、淋巴細胞、樹突狀細胞、瘤細胞、間充質干細胞等。外泌體在免疫中抗原呈遞、瘤的生長與遷移、組織損傷的修復等生理病理上起著重要的作用。同時,不同細胞分泌的外泌體具有不用的組成成分和功能,可作為疾病診斷的生物標志物。細胞外囊泡是蛋白質、mRNA、miRNA和脂質運輸來完成細胞間通訊通路的重要媒介,根據它們的大小和發生分為三類,包括外泌體、微泡和凋亡小體。其中,外泌體是直徑大約為40-100nm的包裝囊泡,由多種細胞分泌,內含有特定的蛋白質、脂質、細胞因子或遺傳物質。來源于不同的組織的外泌體不光具有其特異性蛋白分子,而且還包含其行使功能的關鍵分子
外泌體的提取方法:1.超速離心法(差速離心)。超離法是較常用的外泌體純化手段,采用低速離心、高速離心交替進行,可分離到大小相近的囊泡顆粒。超離法因操作簡單,獲得的囊泡數量較多而廣受歡迎,但過程比較費時,且回收率不穩定(可能與轉子類型有關),純度也受到質疑;此外,重復離心操作還有可能對囊泡造成損害,從而降低其質量。2.密度梯度離心。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。通過密度梯度離心,樣品中的外泌體將在1.13-1.19g/ml的密度范圍富集。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感外泌體提取:聚乙二醇(PEG)為常用的多聚物,可與疏水性蛋白和脂質分子結合共沉淀。
外泌體作為近幾年來的研究熱點,受到了科研工作者的青睞及追捧。由于外泌體內攜帶有大量的miRNA,少量lncRNA,Mrna以及DNA蛋白質成為液體活檢的潛力無限的研究對相。所以,獲得純度高、內容物完整的外泌體非常之重要,那么,外泌體的提取方法也顯得尤為重要。一、差速離心法差速離心法可以說是傳統普遍的外泌體提取方法。原理是:首先低速離心以除去細胞和細胞凋亡碎片;隨后,高速離心以去除大囊泡;高速離心以沉淀外泌體。蘇州君欣生物科技有限公司由于外泌體的特殊結構和功能,使得它具有潛在的應用價值。開封外泌體提取試劑生產廠家
外泌體提純試劑盒的特色與優勢:無需蛋白酶處理。南昌正規外泌體提取試劑推薦廠家
外泌體(exosomes)是活細胞經過"內吞-融合-外排"等一系列調控過程而形成的膜性囊泡,來源于晚期核內體(也稱為多囊泡體),直徑約為30-150nm,密度在1.13-1.21g/ml,天然存在于血液、唾液、尿液及母乳等體液中,同時外泌體也存在于組織和細胞間隙中。人體中幾乎所有類型的細胞均能產生外泌體,人體中大約有1014個外泌體,大約平均每個細胞產生1000-10000個。外泌體中含有核酸(DNA、miRNA、lncRNA、mRNA、tRF等)、蛋白和脂類,在細胞間物質和信息轉導中發揮重要作用,研究表明其在干細胞、免疫調控、瘤轉移、血管生成以及生物標志物等領域都發揮著不可替代的作用。南昌正規外泌體提取試劑推薦廠家